En los últimos meses, la comunidad del VIH ha sido sacudida por una noticia sorprendente: el anuncio de un revolucionario medicamento que, con solo dos dosis al año, podría prevenir la transmisión del VIH en un 100% de los casos. Este avance, que podría tener un coste de apenas €40 por dosis, permanece bajo el control de la industria farmacéutica que lo desarrolló, limitando su accesibilidad. Esta prometedora y costosa innovación podría ser un hito crucial en los esfuerzos para alcanzar las metas urgentes de ONUSIDA y poner fin a la epidemia del sida como una amenaza para la salud pública para el año 2030. Pero no nos adelantemos y vayamos paso a paso, repasemos algunas preguntas que surgen ante estas noticias:
¿Cuál es este nuevo medicamento? ¿Ya está disponible para su uso?
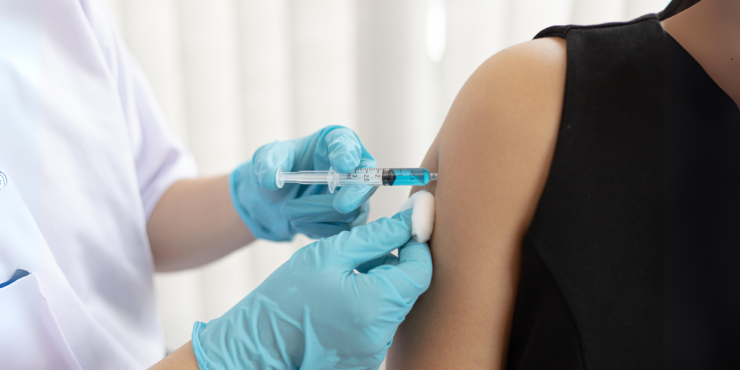
El medicamento en cuestión se llama lenacapavir y pertenece a un grupo de antiretrovirales conocidos como inhibidores de cápside. La cápside es una capa de proteínas que protege el material genético del virus y este fármaco actúa alterándola en múltiples etapas del ciclo de vida vírico, impidiendo que el VIH se multiplique y reduciendo así su concentración en el cuerpo.
Lenacapavir recibió la aprobación como tratamiento para el VIH de la EMA (Agencia Europea de Medicamentos) en agosto de 2022 y de la FDA (Food and Drug Administration) de EEUU en diciembre del mismo año. Esta aprobación se basó en los resultados del CAPELLA, un ensayo clínico multicéntrico, parcialmente aleatorizado, doble ciego (ni los participantes ni los investigadores saben quién está recibiendo el tratamiento activo y quién está recibiendo el placebo) y controlado contra placebo que involucró a 72 personas con VIH multirresistente a otros fármacos, y hasta el momento, esta es la única indicación aprobada para lenacapavir. Es decir, está autorizado para ser usado como tratamiento, no como profilaxis.
¿Pero se puede utilizar como profilaxis pre-exposición (PrEP)?
El ensayo clínico PURPOSE 1 es el único, hasta el momento, que lo ha estudiado como estrategia de PrEP y del cual tenemos datos: los resultados preliminares fueron presentados en la Conferencia Internacional sobre el SIDA llevada a cabo en Múnich el pasado mes de julio. El objetivo del estudio fue evaluar la seguridad y la eficacia del lenacapavir subcutáneo, administrado dos veces al año, en comparación con dos formulaciones diferentes de emtricitabina/tenofovir tomadas por vía oral diariamente. Participaron más de 5.000 adolescentes y mujeres jóvenes cisgénero en Sudáfrica y Uganda, con un rango etario comprendido entre los 16 y 25 años de edad. La mayoría eran de etnia negra, solteras y se encontraban en una situación de alto riesgo de adquirir el VIH (más de un tercio presentaba alguna ITS al inicio del estudio). Tras un año de seguimiento, las 2.134 mujeres que recibieron lenacapavir no registraron ninguna nueva infección por VIH, frente a unos pocos nuevos casos ocurridos en los grupos asignados a la PrEP vía oral.
¿Podemos afirmar que el Lenacapavir es eficaz y seguro para ser utilizado como PrEP?
Esta es una de las preguntas más complejas de responder. Aunque los resultados del estudio PURPOSE 1 fueron tan prometedores que el comité independiente de monitoreo de datos recomendó a la empresa farmacéutica responsable del estudio que suspendiera la fase ciega (es decir, que dejara de mantener en secreto qué participantes recibían cada fármaco) y ofreciera lenacapavir a todos los participantes, todavía hay varias cuestiones a considerar antes de recomendar su uso generalizado:
La población específica en la cual fue estudiado hace necesario probarlo en otras poblaciones más heterogéneas antes de transpolar los resultados a otros colectivos; aunque el lenacapavir está autorizado para su uso como tratamiento para el VIH, ninguna entidad reguladora (EMA, FDA) ha aprobado aún su uso como PrEP; hay información sobre efectos secundarios que no ha sido divulgada, como por ejemplo la tendencia del lenacapavir a la formación de nódulos debajo de la piel en el sitio de inyección; aunque la adherencia al lenacapavir subcutáneo administrado dos veces al año fue superior a la de otros grupos de PrEP con dosis orales y administración diaria, la tolerabilidad del medicamento (es decir, cómo los participantes lo manejan en términos de efectos secundarios y comodidad) y las tasas de abandono del ensayo (la cantidad de participantes que dejaron de participar antes de que el estudio terminara) no están del todo claras.
¿Se está estudiando en otras poblaciones?
Sí, se están llevando a cabo otros ensayos clínicos (PURPOSE 2 al 5) para evaluar el lenacapavir en diferentes poblaciones y países (Estados Unidos, Sudáfrica, Perú, Brasil, Argentina, Tailandia, Francia y el Reino Unido), estando algunos en fase de seguimiento y otros en fase de reclutamiento de participantes. Estas nuevas poblaciones a estudiar incluyen hombres y mujeres cisgénero, hombres transgénero, personas no binarias y usuarios de drogas intravenosas.
¿Entonces por qué es tan caro? ¿Qué significa que tenga “patente”?
El precio de los medicamentos suele ser difícil de entender. No existe una metodología clara para determinar el costo real de su investigación, desarrollo y producción. La mayoría de la información proviene de la misma industria farmacéutica, que establece el precio, lo que puede generar ciertos sesgos.
Tener una patente significa que la empresa que desarrolló el invento (en este caso un medicamento) tiene un monopolio temporal, lo que le permite venderlo en exclusiva y controlar su precio. Esto retrasa la competencia y mantiene los precios altos. La patente dura 20 años desde que se registra el compuesto en la Oficina de Patentes, durante los cuales la empresa puede fabricar, comercializar y exportar el medicamento de manera exclusiva.
Un dato importante es que pocas compañías farmacéuticas poseen la mayoría de las innovaciones en este campo. Esto significa que el acceso a estos medicamentos depende en gran medida de las decisiones empresariales. El medicamento se trata más como un bien de mercado que como un bien sanitario, y está regulado por normas de la Organización Mundial de Comercio (OMC), no por la Organización Mundial de la Salud (OMS).
Actualmente el coste de dos inyecciones de lenacapavir en España (es decir, 2 viales de 1,5 ml, lo cual sería un año de profilaxis) es de poco más de €20.000, aunque podría ser inferior según acuerdos confidenciales entre la industria farmacéutica y el Ministerio de Sanidad. En Estados Unidos este costo asciende a casi el doble. Un estudio británico presentado en Múnich (en la misma Conferencia Internacional sobre el SIDA donde se presentaron los resultados del PURPOSE 1) sugiere que la producción en masa podría reducir su precio a unos €80 al año comparados con los €20.000 actuales. De nada sirve que un medicamento sea eficaz, seguro y conveniente si no es accesible a la población que le necesita y que se vería beneficiada con su consumo.
Sin embargo, hay esperanza. La Declaración de Doha de la OMC en 2001 apoya la flexibilidad en la propiedad intelectual para permitir a los países en desarrollo acceder a medicamentos asequibles. Este acuerdo se considera un logro importante en el acceso a medicamentos, priorizando la salud pública sobre los derechos de propiedad intelectual.
Será necesario que pase más tiempo y que dispongamos de más datos que avalen la eficacia y seguridad del lenacapavir como PrEP. Solo entonces podremos entablar una discusión informada y tomar medidas concretas respecto al precio de medicamentos que, como este, tienen el potencial de cambiar el curso de una epidemia a un costo accesible y racional.
Referencias bibliográficas:
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Ficha Técnica Sunlenca 300 mg comprimidos recubiertos con película. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/1221671001/FT_1221671001.html.pdf
- Ministerio de Sanidad, Agencia Europea de Medicamentos. Twice-Yearly PrEP Gives ‘Huge’ 100% Protection. Medscape, 25 de julio de 2024.
- Ministerio de Sanidad, Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Informe de Posicionamiento Terapéutico de lenacapavir (Sunlenca®) en pacientes con infección por VIH-1 multirresistente (IPT-233/V1/08022024). Disponible en: https://www.mscbs.gob.es/
- Vidal Gil, L. Lenacapavir, el nuevo fármaco de acción prolongada contra el VIH-1. Actualidad en Farmacología y Terapéutica, 21(1), 55. Universidad de Alicante, 2024.
- Manzano Lorenzo, J., & Alonso Ruiz, A. Las barreras de las farmacéuticas pueden frenar la nueva revolución en la lucha contra el sida. El País, 16 de julio de 2024. Disponible en: https://elpais.com/planeta-futuro/2024-07-16/las-barreras-de-las-farmaceuticas-pueden-frenar-la-nueva-revolucion-en-la-lucha-contra-el-sida.html
- Médicos Sin Fronteras. Activistas demandan la ruptura del monopolio del lenacapavir de Gilead en la Conferencia Internacional de Sida. 24 de julio de 2024. Disponible en: https://www.msf.es/noticia/activistas-demandan-ruptura-monopolio-lenacapavir-gilead-conferencia-sida
















Qué gusto de artículo! Que alguien haga un aproximación critica a la industria farmacéutica es insólito hoy en día. Destacar también el el tono pedagógico, Felicidades y muchas gracias!